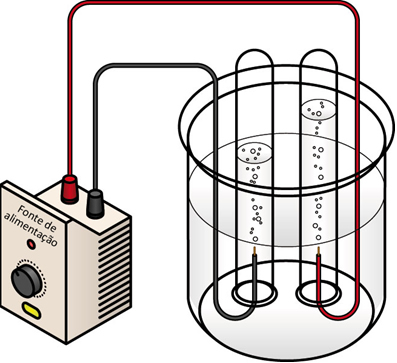
Trata-se da decomposição de água (H2O) em oxigênio (O2) e hidrogênio (2H2) por efeito da passagem de uma corrente elétrica pela água. No entanto, este processo eletrolítico raramente é usado em aplicações industriais uma vez que o hidrogênio pode ser produzido mais acessivelmente através de combustíveis fósseis. Uma fonte de energia eléctrica está ligada a dois elétrodos (geralmente feitos a partir de alguns metais inertes como a platina ou o aço inoxidável, no caso da imagem, é usada a grafite) que estão colocados na água. Se tudo estiver corretamente montado, origina-se hidrogênio no cátodo (o eléctrodo ligado ao terminal negativo da fonte de energia) e oxigênio no ânodo (o eléctrodo ligado ao terminal positivo da fonte de energia).
É necessária uma enorme quantidade de energia para fazer a eletrólise da água pura uma vez que esta não é boa condutora eléctrica. Sem o excesso de energia a electrólise da água pura ocorre muito lentamente. Isto deve-se á limitada auto-ionização da água: a cada 555 milhões de moléculas, somente uma se ioniza.
A condutividade elétrica da água pura é cerca de um milhão de vezes menor que a da água do mar. A eficácia da eletrólise da água pode ser aumentada adicionando um electrólito (como sal, um ácido ou uma base) e/ou utilizando eletro catalisadores.
terminal positivo da fonte de energia).
É necessária uma enorme quantidade de energia para fazer a eletrólise da água pura uma vez que esta não é boa condutora eléctrica. Sem o excesso de energia a electrólise da água pura ocorre muito lentamente. Isto deve-se á limitada auto-ionização da água: a cada 555 milhões de moléculas, somente uma se ioniza. A condutividade eléctrica da água pura é cerca de um milhão de vezes menor que a da água do mar. A eficácia da electrólise da água pode ser aumentada adicionando um electrólito (como sal, um ácido ou uma base) e/ou utilizando eletro catalisadores.
História
Jan Rudolph Deiman e Adriaan Paets van Troostwijk usaram em 1789 uma máquina electro estática para produzir eletricidade que foi descarregada em eletrodos de ouro em uma garrafa de Leyden com água. Em 1800, Alessandro Volta inventou a pilha. Algumas semanas mais tarde William Nicholson e Anthony Carlisle usaram-na para a eletrólise da água. Quando Zenobe Gramme inventou a máquina de Gramme, em 1869, a eletrólise da água tornou-se um método barato para a produção de hidrogênio.
Tal esse processo ocorre quando há uma passagem de corrente elétrica numa solução aquosa, isto é, com um sal, um ácido ou uma base, dissolvidos em água e que se ionizam ou sofrem dissociação iônica, originando íons livres.
Os íons da água interferem nas eletrólises em meio aquoso, porque eles podem se depositar nos eletrodos se a sua tendência for maior do que a dos íons da substância dissolvida.
Quando está na sua forma pura, porém, a água (destilada) é má condutora de eletricidade e não é possível realizar a sua decomposição eletrolítica. Isso acontece porque a autoionização da água é muito pequena e insuficiente para conduzir corrente elétrica.
Então, se quisermos causar uma eletrólise do cátion e do ânion da água, teremos que dissolver algum soluto que contenha íons mais reativos que os da água, que não participem das reações envolvidas.
